Mab's binden zich met een hoge specificiteit en affiniteit aan hun doel. Dit verklaart mede de hoge effectiviteit en het overwegend gunstige bijwerkingenprofiel van mAb's. Ze zijn door hun specifieke werkingsmechanisme in principe inzetbaar tegen zeer diverse eiwitten en vinden daarom toepassing bij uiteenlopende ziektebeelden. Voor het begrip van een mAb-therapie is het onderscheidt tussen een direct en indirect werkingsmechanisme van groot belang.
Wat houdt een (in)direct werkingsmechanisme in?
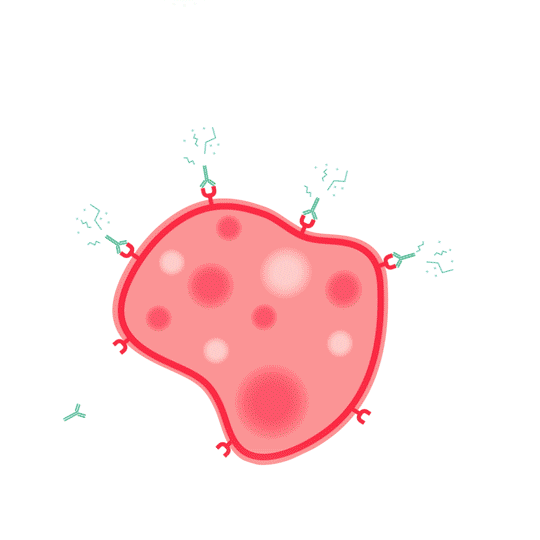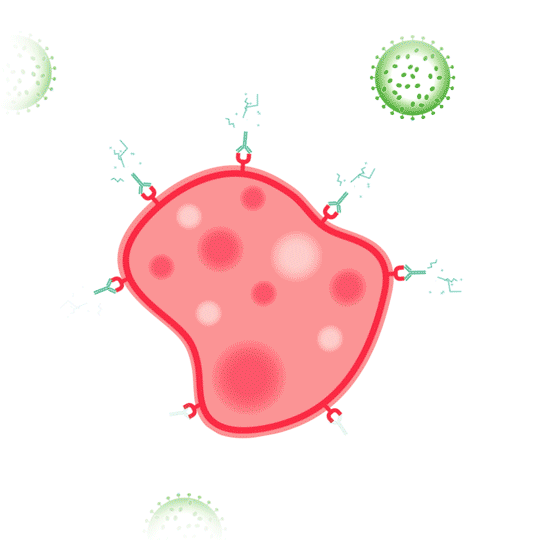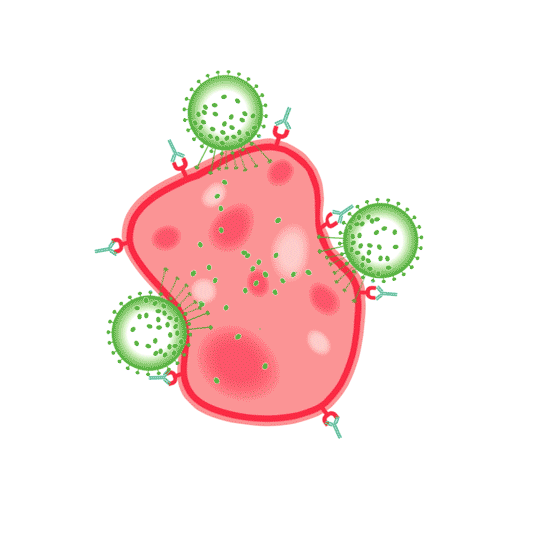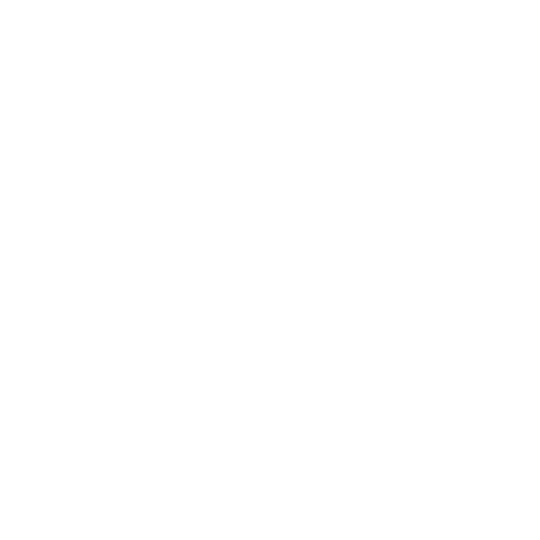
Een mAb met een direct werkingsmechanisme bindt direct aan de receptor, of aan het ligand van een receptor, en blokkeert zo de cellulaire signalering van de doelcel. Dit betekent dat de antilichamen aan bepaalde gedeeltes van het antigeen binden, waardoor het antigeen geen interacties met cellen of moleculen meer aan kan gaan. Het antigeen verliest hierdoor zijn werking. Dit principe wordt ook wel neutralisatie genoemd. Er is in dit geval geen activering van het immuunsysteem vereist.
Bij een indirect werkingsmechanisme wordt het immuunsysteem juist wél geactiveerd. In dit geval leidt binding van het antilichaam tot celdood van het doel, door toedoen van het immuunsysteem. Deze celdood kan onder andere op de volgende twee manieren worden geïnduceerd: aan de hand van antilichaamafhankelijke cellulaire cytotoxiciteit (ADCC) of van complement-afhankelijke cytotoxiciteit (CDC).1
Wat houdt ADCC en CDC in?
ADCC is celgemedieerde cytotoxiciteit die afhankelijk is van antistoffen en voor een groot deel van natural killer (NK)-cellen. Bij ADCC binden antilichamen aan antigenen op het oppervlak van de targetcel. Vervolgens herkennen en binden NK-cellen aan het FC-gedeelte van celgebonden antilichamen, waarna NK-cellen cytotoxische factoren afgeven. Dat leidt tot lysis van het membraan en de uiteindelijke celdood van de doelcel.1
CDC is een reactie waarbij het antilichaam, gebonden aan het antigeen, een cascade activeert van het complementsysteem. Het complementsysteem bestaat uit zogeheten complementfactoren, die via een kettingreactie (cascade) aanleiding geven tot lysis van de met antilichamen bedekte doelcel. Dit systeem van eiwitten “complementeert” antilichamen en fagocyterende cellen als onderdeel van het aangeboren afweersysteem. De complementfactoren binden aan het constante FC-gedeelte van het antilichaam, waardoor zich een “membrane attack complex” vormt. Dit complex verstoort het celmembraan, wat leidt tot celdood.1
Welk belang hebben het isotype en de subklasse immunoglobuline bij het inzetten van mAb’s?
De bovengenoemde werkingsmechanismes van het antilichaam worden bepaald door het isotype. Er zijn 5 verschillende soorten immunoglobulinen (Ig), namelijk IgG, IgA, IgD, IgE en IgM. Het belangrijkste Ig in het serum is IgG. Van alle Ig-isotypen is IgG het meest stabiel en bezit het de langste halfwaardetijd, van tussen de 20 en 24 dagen. Hierdoor hoeft minder vaak gedoseerd te worden, is de dosering flexibeler, en is de tevredenheid en therapietrouw van de patiënt hoger.2,3
IgG kent ook weer vier subklassen: IgG1, IgG2, IgG3 en IgG4, met verschillende biologische eigenschappen en verschillende effecten op de immuunfunctie.
Tabel. IgG-subklassen en hun effecten op de immuunfunctie.3
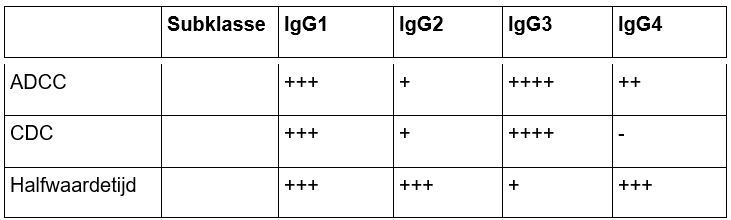
IgG1 wordt het meest gebruikt om therapeutische mAb's te genereren. Een belangrijke reden is dat IgG1 het immuunsysteem in sterke mate kan aanzetten tot zowel ADCC als CDC; dit is een belangrijke “effectorfunctie” van IgG. IgG2 of IgG4 worden gebruikt wanneer juist een mildere effectorfunctie gewenst is.
Meer weten?
Bekijk hier de video: 'Werkingsmechanismen van mAb's'.
Wat zijn de mogelijke bijwerkingen van mAb's?
Therapeutische mAb's worden over het geheel genomen goed verdragen.5 Door hun hoge moleculaire gewicht ( ̴150 dKa) zijn mAb's op basis van IgG te groot om door de bloed-hersenbarrière heen te dringen; neurologische bijwerkingen zijn hierdoor zeer beperkt.5
In het algemeen kunnen bij mAb's twee soorten acute bijwerkingen optreden.6 Ten eerste bijwerkingen die afhankelijk zijn van het werkingsmechanisme en de interactie met het doelwit. Dergelijke bijwerkingen kunnen optreden door effecten van het mAb op het target, of door effecten op het target-antigeen buiten het targetweefsel. Een voorbeeld zijn mAbs gericht tegen de expressie van epidermale groeifactorreceptor (EGFR) op tumorcellen, die ook huidreacties kunnen veroorzaken.
Ten tweede bijwerkingen die niet voortkomen uit de interactie met het doelwit, maar met de mAb zelf. Voorbeelden zijn infusiegerelateerde symptomen zoals algehele malaise, of plaatselijke reacties zoals roodheid en jeuk bij subcutaan of intramusculair toegediende mAb's.
Naast bovengenoemde acute bijwerkingen kunnen zich op den duur soms neutraliserende antilichamen vormen.
Wat zijn neutraliserende antilichamen?
Vrijwel alle biologicals, inclusief mAb's, kunnen resulteren in immunogeniciteit. Zelfs volledig gehumaniseerde mAb's kunnen immunogeen zijn. Bij deze ongewenste immuunreactie worden antilichamen gevormd: “anti-drug antibodies” (ADA's).7 Vaak merkt de patiënt hier niets van; soms veroorzaken ADA's overgevoeligheid of infusiereacties. Wat vaker voorkomt, is dat ze het farmacologisch effect van de mAb verminderen (neutraliserende antilichamen) of de plasmaspiegel verlagen (klarende antilichamen). In sommige ernstige gevallen kunnen ADA de therapeutische effecten van een mAb sterk verminderen en/of ernstige bijwerkingen veroorzaken.
Bij de vorming van ADA kunnen zowel patiëntgerelateerde factoren meespelen (zoals genetische achtergrond, ziektestadium en comedicatie) als mAb-gerelateerde factoren (waaronder mate van humanisatie, mAb-taget, onzuiverheden, dosis en frequentie). De kans op de vorming van ADA en neutraliserende ADA kunnen sterk verschillen per mAb.7,8