Bijsluiter & SmPC
Download risicominimalisatie-materiaal Beovu
▼ Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. U kunt hieraan bijdragen door melding te maken van alle bijwerkingen die u eventueel zou ervaren. U leest hier hoe u dat kunt doen.
Wat is Beovu?
Beovu bevat de werkzame stof brolucizumab, die behoort tot een groep van geneesmiddelen die anti-neovasculariserende middelen (middelen tegen nieuwgroei van kleine bloedvaten) worden genoemd. Beovu wordt door uw arts in het oog geïnjecteerd om oogziekten te behandelen waardoor u slechter kunt gaan zien.
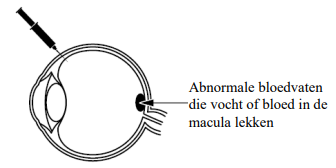
Waarvoor wordt Beovu gebruikt?
Beovu wordt gebruikt voor de behandeling van oogziekten bij volwassenen die optreden als er abnormale bloedvaten onder de macula (gele vlek) ontstaan en groeien. De macula, welke achter in het oog is, zorgt voor helder zicht. De abnormale bloedvaten kunnen vocht of bloed in het oog lekken, waardoor de macula minder goed gaat werken. Dit kan leiden tot aandoeningen die ervoor kunnen zorgen dat het gezichtsvermogen vermindert, zoals:
- natte leeftijdsgebonden maculadegeneratie (natte LMD)
- diabetisch macula-oedeem (DME)
Therapeutische indicaties
Beovu is geïndiceerd voor gebruik bij volwassenen voor de behandeling van:
- neovasculaire (natte) leeftijdsgebonden maculadegeneratie (LMD) (zie rubriek 5.1 van de SmPC),
- visusverslechtering als gevolg van diabetisch macula-oedeem (DME) (zie rubriek 5.1 van de SmPC).
Dosering
Natte LMD
Start van de behandeling - opladen
De aanbevolen dosering is 6 mg brolucizumab (0,05 ml oplossing), toegediend als intravitreale injectie, elke 4 weken (maandelijks) voor de eerste 3 doses. Een beoordeling van de ziekteactiviteit wordt aanbevolen 16 weken (4 maanden) na de start van de behandeling.
Als alternatief kan 6 mg brolucizumab (0,05 ml oplossing) elke 6 weken worden toegediend voor de eerste 2 doses. Een beoordeling van de ziekteactiviteit wordt aanbevolen 12 weken (3 maanden) na de start van de behandeling. Een derde dosis kan worden toegediend op basis van ziekteactiviteit, te beoordelen aan de hand van gezichtsscherpte en/of anatomische parameters in week 12.
Onderhoudsbehandeling
Na de laatste oplaaddosis, kan de arts de behandelintervallen individueel aanpassen op basis van ziekteactiviteit, te beoordelen aan de hand van gezichtsscherpte en/of anatomische parameters. Bij patiënten zonder ziekteactiviteit, moet een behandeling elke 12 weken (3 maanden) overwogen worden. Bij patiënten met ziekteactiviteit, moet een behandeling elke 8 weken (2 maanden) overwogen worden (zie rubriek 4.4 en 5.1 van de SmPC).
Indien visuele en anatomische resultaten erop duiden dat de patiënt geen baat heeft bij voortgezette behandeling, dient de behandeling met Beovu stopgezet te worden.
DME
De aanbevolen dosering is 6 mg brolucizumab (0,05 ml oplossing), toegediend als intravitreale injectie, elke 6 weken voor de eerste 5 doses.
Daarna kan de arts de behandelintervallen individueel aanpassen op basis van ziekteactiviteit, te beoordelen aan de hand van gezichtsscherpte en/of anatomische parameters. Bij patiënten zonder ziekteactiviteit, moet een behandeling elke 12 weken (3 maanden) overwogen worden. Bij patiënten met ziekteactiviteit, moet een behandeling elke 8 weken (2 maanden) overwogen worden. Na 12 maanden behandeling kunnen bij patiënten zonder ziekteactiviteit behandelintervallen tot 16 weken (4 maanden) worden overwogen (zie rubriek 4.4 en 5.1 van de SmPC).
Indien visuele en anatomische resultaten erop duiden dat de patiënt geen baat heeft bij voortgezette behandeling, dient de behandeling met Beovu stopgezet te worden.
Speciale populaties
Ouderen
Er is geen aanpassing van de dosis nodig voor patiënten ouder dan 65 jaar (zie rubriek 5.2 van de SmPC).
Nierinsufficiëntie
Er is geen aanpassing van de dosis nodig voor patiënten met nierinsufficiëntie (zie rubriek 5.2 van de SmPC).
Leverinsufficiëntie
Brolucizumab is niet onderzocht bij patiënten met leverinsufficiëntie. Er is geen aanpassing van de dosis nodig voor patiënten met leverinsufficiëntie (zie rubriek 5.2 van de SmPC).
Pediatrische patiënten
De veiligheid en werkzaamheid van brolucizumab bij kinderen en adolescenten jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Beovu is uitsluitend bestemd voor intravitreaal gebruik.
De oplossing voor injectie moet voorafgaand aan toediening visueel gecontroleerd worden (zie rubriek 6.6 van de SmPC).
De intravitreale injectieprocedure moet worden uitgevoerd onder aseptische omstandigheden: dit impliceert een chirurgische desinfectie van de handen, het gebruik van steriele handschoenen, een steriel laken en een steriel ooglidspeculum (of equivalent). Steriele paracentese-uitrusting dient als voorzorgsmaatregel beschikbaar te zijn. De medische voorgeschiedenis van de patiënt voor overgevoeligheidsreacties moet zorgvuldig worden geëvalueerd voordat de intravitreale procedure wordt uitgevoerd (zie rubriek 4.3 van de SmPC). Geschikte anesthesie en een topisch breedspectrum microbicide, om de perioculaire huid, het ooglid en het oculaire oppervlak te desinfecteren, moeten worden toegediend voorafgaand aan de injectie.
De injectienaald moet worden ingebracht in de vitreale holte 3,5 tot 4,0 mm achter de limbus, waarbij de horizontale meridiaan moet worden vermeden en de naald moet worden gericht op het midden van de oogbol. Het injectievolume van 0,05 ml wordt vervolgens langzaam ingebracht. Voor de volgende injecties wordt een andere sclerale plaats gebruikt.
Onmiddellijk na de intravitreale injectie moeten patiënten gecontroleerd worden op toename in intraoculaire druk. Een gepaste controle kan bestaan uit controle op de perfusie van de oogzenuw (papil) of tonometrie. Indien nodig, dient steriele paracentese-uitrusting beschikbaar te zijn.
Na intravitreale injectie moet aan patiënten worden uitgelegd dat zij alle symptomen die op endoftalmitis lijken (zoals oogpijn, roodheid van het oog, fotofobie, wazig zicht) direct moeten melden.
Voorgevulde spuit
De voorgevulde spuit is uitsluitend bedoeld voor eenmalig gebruik. Elke voorgevulde spuit mag uitsluitend gebruikt worden voor de behandeling van één oog.
Aangezien het volume in de voorgevulde spuit (0,165 ml) groter is dan de aanbevolen dosis (0,05 ml), moet een deel van het volume in de voorgevulde spuit worden verwijderd vóór toediening.
Het injecteren van het gehele volume van de voorgevulde spuit kan leiden tot overdosering. Druk de zuiger langzaam in totdat de rand onder de top van de rubber stop zich op één lijn bevindt met de doseringsstreep van 0,05 ml (equivalent aan 50 µl, d.w.z. 6 mg brolucizumab) om de luchtbel samen met het teveel aan geneesmiddel te verwijderen.
Injectieflacon
De injectieflacon is uitsluitend bedoeld voor eenmalig gebruik. Elke injectieflacon mag uitsluitend gebruikt worden voor de behandeling van één oog.
Aangezien het volume in de injectieflacon (0,23 ml) groter is dan de aanbevolen dosis (0,05 ml), moet een deel van het volume in de injectieflacon worden verwijderd vóór toediening.
Het injecteren van het gehele volume van de injectieflacon kan leiden tot overdosering. Om de luchtbel samen met het teveel aan geneesmiddel te verwijderen, moet de lucht voorzichtig uit de spuit worden verdreven en de dosis worden aangepast tot de doseringsstreep van 0,05 ml (equivalent aan 50 µl, d.w.z. 6 mg brolucizumab).
Voor instructies over de bereiding van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6 van de SmPC.
Vragen over onze geneesmiddelen
Veiligheid van de patiënt staat bij ons hoog in het vaandel. Daarom is onze Medische Informatie Dienst bereikbaar voor vragen van patiënten en professionals in de gezondheidszorg met betrekking tot alle aspecten van het gebruik of informatie over een geneesmiddel van Novartis.
Contactinformatie
E: [email protected]
T: 088-0452111
Bijwerking melden
Als we op de hoogte zijn van eventuele bijwerkingen, kunnen we die verder onderzoeken. We verzoeken je om bijwerkingen direct bij ons te melden. Novartis zal de informatie verwerken en eventueel contact met je opnemen. Je kunt een bijwerking bij ons melden via het onderstaande contactformulier.
